CARBONO: ELEMENTO PREDOMINANTE EN LOS ALIMENTOS
El Carbono, de símbolo C, es un elemento crucial para la existencia de los organismos vivos, y que tiene muchas aplicaciones industriales importantes. Su número atómico es 6; y pertenece al grupo 14 (o IV A) del sistema periódico.
El carbono es un elemento único en la naturaleza ya que tiene la cualidad de formar muchos compuestos, característica que no presentan el resto de elementos que existen en nuestro entorno. Se encuentra libre en la corteza terrestre en diferentes formas alotrópicas y también formando compuestos presentes en diversos minerales como caliza, dolomita, yeso, mármol, carbonatos, entre otros.
Una característica importante del carbono es la extensa variedad de compuestos que forma cuando se combina con hidrógeno, oxígeno, nitrógeno y otros elementos, que son la base principal de la composición de todos los seres vivos, animales y vegetales, razón por la que se les llama compuestos orgánicos.
A continuación puedes ver una tabla donde se muestra las principales características que tiene el carbono.
Carbono
| ||
Símbolo químico
|
C
| |
Número atómico
|
6
| |
Grupo
|
14
| |
Periodo
|
2
| |
Aspecto
|
negro (grafito) Incoloro (diamante)
| |
Bloque
| ||
Densidad
|
2267 kg/m3
| |
Masa atómica
|
12.0107 u
| |
Radio medio
|
70 pm
| |
Radio atómico
|
67
| |
Radio covalente
|
77 pm
| |
Radio de van der Waals
|
170 pm
| |
Configuración electrónica
|
[He]2s22p2
| |
Electrones por capa
|
2, 4
| |
Estados de oxidación
|
4, 2
| |
Óxido
|
ácido débil
| |
Estructura cristalina
|
hexagonal
| |
Estado
|
sólido
| |
Punto de fusión
|
diamante: 3823 K Grafito: 3800 K K
| |
Punto de ebullición
|
grafito: 5100 K K
| |
Calor de fusión
|
grafito; sublima: 105 kJ/mol kJ/mol
| |
Electronegatividad
|
2,55
| |
Calor específico
|
710 J/(K·kg)
| |
Conductividad eléctrica
|
61×103S/m
| |
Conductividad térmica
|
129 W/(K·m)
| |
Valencia
|
2,+4,-4
| |
El carbono forma enlaces consigo mismo, lo que se conoce como enlaces carbono-carbono, ya que el carbono es tetravalente, lo que le hace tener la posibilidad de formar enlaces con otros átomos de carbono y otros elementos, como por ejemplo el hidrógeno en el caso de los hidrocarburos. Precisamente por la gran facilidad que posee el carbono de enlazarse entre sí formando cadenas, existen tantos tipos diferentes de hidrocarburos.
Los enlaces carbono-carbono, son enlaces de tipo covalente, que tienen lugar entre dos átomos de carbono. Existen enlaces simples, que generalmente son los más comunes, pues se encuentra formado por dos electrones, siendo cada uno de uno de los átomos que participan en el enlace. Los enlaces simples son de tipo sigma (enlace σ), siendo este el más fuerte de los enlaces covalentes, y se encuentran formados por un orbital híbrido de los átomos de carbono del enlace.
Los átomos de carbono al enlazarse también pueden formar enlaces dobles (alquenos), formados por orbitales híbridos sp^2 y dos p, en cambio los enlaces triples (alquinos), formados por un orbital híbrido sp y dos p de cada uno de los átomos.
Como ya se ha mencionado, el carbono posee la característica de poder formar cadenas largas y bastante estables, dicha característica o propiedad recibe el nombre de concatenación.
La concatenación y la fuerza característica de los enlaces tipo carbono-carbono, hacen posible la formación de un gran número de moléculas, muchísimas de ellas esenciales para la vida, dando a este tipo de enlaces gran importancia, así como al carbono en general, tema de estudio en la química orgánica, que es rama de la química dedicada al estudio del carbono y sus combinaciones.
Las cadenas de enlaces C-C, forman verdaderos esqueletos carbonados, a menudo con ramificaciones. En dichas ramificaciones podemos diferenciar distintos tipos de carbono, dependiendo del número de carbonos que estén enlazados, es decir, dependiendo de cuantos carbonos tenga como vecinos un átomo de carbono.
- Carbono primario: tiene un átomo de carbono como vecino.
- Carbono secundario: el carbono tiene dos átomos de carbono como vecino.
- Carbono terciario: el carbono tiene tres átomos de carbono como vecinos.
- Carbono cuaternario: el carbono posee cuatro átomos de carbono como vecinos.
Las reacciones orgánicas de formación de los enlaces carbono- carbono, son reacciones donde se producen nuevos enlaces del mismo tipo, es decir, carbono –carbono, de muchísima importancia en la industria, en la fabricación de, entre otras cosas, los plásticos.
Existen muchas reacciones que producen enlaces carbono-carbono, como por ejemplo la adición de un reactivo de Grignard a un grupo carbonilo (átomo de carbono con doble enlace a un átomo de oxígeno). Los reactivos de Grignard son compuestos de tipo organometálicos siendo quizás los reactivos de mayor importancia dentro de la química orgánica gracias a su rapidez de reacción.
Los enlaces del carbono con el hidrógeno (C-H), también son enlaces de tipo covalente, siendo éstos sumamente abundantes entre los compuestos orgánicos. Estos enlaces junto a los enlaces C-C, forman los conocidos hidrocarburos, dividiéndose éstos en alcanos, alquenos, alquinos e hidrocarburos aromáticos.
De la misma manera, el carbono forma enlaces con muchos elementos de la tabla periódica como los alcalinos y alcalinotérreos (menos el francio, bario y radio), también forma enlaces con la mayoría de los metales y muchos de los elementos de transición e incluso algunas tierras raras.
El carbono forma diferentes compuestos inorgánicos que son :
Carburos: son compuestos que se forman a partir de la unión entre el carbono y u elemento E (generalmente mas electropositivo que el carbono) para dar sustancias del tipo Ex Cy.
Carbonatos: Son sales del acido carbónico o esteres con el grupo R-O-C(=O)-O-R. Las sales tienen en común el anión CO3-2 y se derivan del acido carbónico H2CO3. Según el pH están en equilibrio químico con el bicarbonato y el dióxido de carbono. Formula: CO2-3.
Óxidos: es un compuesto binario que contiene uno o más átomos de oxigeno (el cual normalmente, presenta un estado de oxidación -2), y otros elementos. Existen una gran variedad de óxidos. Es un compuesto inorgánico que se fl unir algún químico con oxigeno. Se clasifican en dos grupos: básicos y ácidos.
Formula: X2On donde x es un símbolo del elemento, el ---- corresponde a la valencia del oxigeno, la O es el símbolo del oxigeno y la --- es la valencia del otro elemento, sea metal o no metal.
Hidrocarburos
Los átomos de carbono se enlazan químicamente entre sí formando largas cadenas lineales o ramificadas, que van desde unos cuantos átomos hasta miles de ellos o bien anillos de todos los tamaños; debido a esta característica se considera al carbono, único en la naturaleza, lo que le permite formar una inimaginable cantidad de compuestos; a esta propiedad del carbono se conoce como concatenación. Como se ha mencionado, los átomos de carbono al combinarse químicamente ya sea entre sí o con átomos de otros elementos siempre van a formar cuatro enlaces,generalmente covalentes. Los enlaces carbono-carbono pueden ser simples, dobles o triples. En las fórmulas desarrolladas de los compuestos orgánicos los átomos de C invariablemente tendrán cuatro enlaces representados mediante líneas; por otro lado, el átomo de hidrógeno al combinarse químicamente sólo puede formar un enlace que se representa con una sola línea; lo anterior puede corroborarse con la siguiente representación:
El siguiente esquema muestra un panorama general de la clasificación de hidrocarburos (compuestos orgánicos formados únicamente por átomos de hidrogeno y carbono).
Alifáticos
Son HC de cadenas abiertas o cerradas y se clasifican en saturados e insaturados dependiendo de la cantidad de átomos de hidrógeno y está determinado por las uniones carbono-carbono, simples, dobles y triples llamados alcanos, alquenos y alquinos respectivamente. Las siguientes fórmulas desarrolladas y semidesarrolladas son ejemplos de HC alifáticos. Son utilizados como disolventes de aceites, grasas, caucho, resinas,etc.
Aromáticos
Son HC cíclicos que contienen la estructura básica del benceno, C6H6. Las siguientes son distintas representaciones del benceno.
Hidrocarburos saturados
Los HC saturados son aquellos compuestos que tienen el máximo de átomos de hidrógeno en su estructura molecular, es decir están saturados de hidrógeno, estos compuestos solamente presentan enlaces sencillos: C-C ó C-H, los HC saturados también son llamados Alcanos o parafinas; el siguiente es un ejemplo de una estructura de hidrocarburo saturado.
Fórmula desarrollada y semidesarrollada de Etano, HC saturado de fórmula condensada: C2H6.
Hidrocarburos insaturados
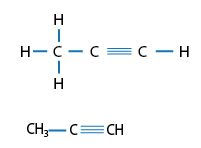
Los HC insaturados son aquellos compuestos que tienen al menos un enlace doble o triple entre los átomos de carbono que los forman; debido a que los átomos de carbono al unirse entre sí con enlaces múltiples agotan las posibilidades de enlazarse con el hidrógeno. La cantidad de átomos de hidrógeno que tienen los HC insaturados es siempre menor a la de los saturados de igual número de átomos de C. De esta forma, los HC saturados se subdividen en Alquenos y Alquinos. Las siguientes representaciones son ejemplos de HC insaturados.
Fórmulas desarrolladas y semidesarrollada de Eteno, HC insaturado de fórmula condensada: C2H4.
Fórmulas desarrolladas y semidesarrollada de Propino, HC insaturado de fórmula condensada: C3H4.
Alcanos
Son aquellos HC que sólo presentan enlaces covalentes simples, pueden ser cadenas abiertas o cerradas, ramificadas o lineales.
Los alcanos son HC saturados, cuya fórmula general es: CnH2n+2, para cadenas abiertas, ya sea lineales o ramificadas. Si la estructura es cíclica la fórmula general es: CnH2n.
Fórmulas desarrollada y semidesarrollada de Hexano, alcano de cadena abierta sin ramificaciones, de fórmula condensada C6H14.
Fórmula semidesarrollada de alcano de cadena cerrada (cíclico) con ramificaciones. Fórmula condensada = C10H20.
Alquenos
Son HC que en su composición tienen menos átomos de hidrógeno que el alcano del mismo número de carbonos, y en su estructura se encuentra por lo menos un enlace doble, también son llamados olefinas.
Los alquenos son HC insaturados con dobles enlaces C=C y fórmula general: CnH2n, para cadenas abiertas, ya sea lineales o ramificadas.
Fórmula semidesarrollada de alqueno de cadena abierta. Fórmula condensada = C8H16.

Fórmula semidesarrollada de alqueno de cadena abierta. Fórmula condensada = C4H8.
Los alquinos son HC insaturados y su fórmula general es CnH2n-2 para cadenas abiertas, ya sea lineales o ramificadas.


Hidrocarburos lineales
Si un HC está constituido por una sola cadena de átomos de carbono, ya sea abierta o cíclica, se clasifica como lineal. La cadena lineal de los HC se aprecia mejor en sus fórmulas semidesarrolladas como se muestra a continuación:

Hidrocarburos ramificados
En el HC ramificado, la cadena de mayor número de átomos de carbono es considerada como la cadena principal y las cadenas adicionales se consideran ramificaciones. En un hidrocarburo cíclico toda cadena adicional a éste se considera una ramificación. En las siguientes estructuras las ramificaciones se señalan con círculos punteados:









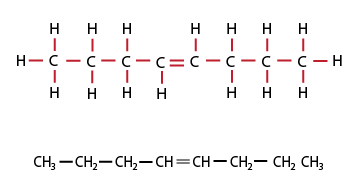
Frida. Saludos muy buen trabajo, queda registrado.
ResponderEliminarProf. Agustín