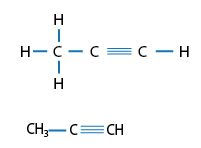
¿QUE SON LOS MEDICAMENTOS?
Sintesis De Acido Acetilsalicilico Por Un Metodo De Quimica
Verde
Práctica 7
OBTENCIÓN DEL ÁCIDO ACETILSALICÍLICO POR MEDIO DE UN PROCESO DE QUÍMICA VERDE.
Universidad Nacional Autónoma de México
Facultad de Química
Resumen
En esta práctica se llevo a cabo la obtención de acido acetilsalicílico por medio de una reacción de esterificación de un derivado de acido carboxílico, este proceso fue llevado a cabo de tal manera que no se afectara al medio ambiente, utilizando en forma eficiente las materias primas, eliminando la generación de desechos y evitando el uso de reactivos y disolventes tóxicos y/o peligrosos.
Introducción
El ácido acetilsalicílico se prepara por acetilación del ácido salicílico mediante un proceso denominado esterificación. La esterificación consiste en la reacción de un grupo carboxilo (-COOH) y un grupo hidroxilo (-OH) para formar un grupo éster (–COOR). En este caso la fuente del grupo –OH es el fenol del ácido salicílico, y el grupo acetilo (-COCH3) proviene del anhídrido acético.
El ácido acetilsalicílico es un éster de ácido acético y ácido salicílico (que actua como alcohol). Aunque se pueden obtener ésteres de ácido por interacción directa del ácido acético con un alcohol o un fenol, se suele usar un derivado de acido, anhídrido acético, como agente acetilante. Éste permite producir ésteres de acetato con velocidad mucho mayor, que por la acción directa del ácido acético.
El ácido salicílico reacciona muy lentamente con el anhídrido acético a ebullición, pero si se agregan unas pocas gotas de ácido sulfúrico concentrado, la reacción procede a temperatura ambiente y además se desarrolla rápidamente con un considerable desprendimiento de calor. Acido Acetilsalicilico
OBTENCIÓN DEL ÁCIDO ACETILSALICÍLICO POR MEDIO DE UN PROCESO DE QUÍMICA VERDE.
Universidad Nacional Autónoma de México
Facultad de Química
Resumen
En esta práctica se llevo a cabo la obtención de acido acetilsalicílico por medio de una reacción de esterificación de un derivado de acido carboxílico, este proceso fue llevado a cabo de tal manera que no se afectara al medio ambiente, utilizando en forma eficiente las materias primas, eliminando la generación de desechos y evitando el uso de reactivos y disolventes tóxicos y/o peligrosos.
Introducción
El ácido acetilsalicílico se prepara por acetilación del ácido salicílico mediante un proceso denominado esterificación. La esterificación consiste en la reacción de un grupo carboxilo (-COOH) y un grupo hidroxilo (-OH) para formar un grupo éster (–COOR). En este caso la fuente del grupo –OH es el fenol del ácido salicílico, y el grupo acetilo (-COCH3) proviene del anhídrido acético.
El ácido acetilsalicílico es un éster de ácido acético y ácido salicílico (que actua como alcohol). Aunque se pueden obtener ésteres de ácido por interacción directa del ácido acético con un alcohol o un fenol, se suele usar un derivado de acido, anhídrido acético, como agente acetilante. Éste permite producir ésteres de acetato con velocidad mucho mayor, que por la acción directa del ácido acético.
El ácido salicílico reacciona muy lentamente con el anhídrido acético a ebullición, pero si se agregan unas pocas gotas de ácido sulfúrico concentrado, la reacción procede a temperatura ambiente y además se desarrolla rápidamente con un considerable desprendimiento de calor. Acido Acetilsalicilico
ACIDO ACETILSALICILICO
El ácido acetilsalicílico o AAS (C9H8O4), también conocido con el nombre de Aspirina®, es un fármaco de la familia de los salicilatos, usado frecuentemente como antiinflamatorio, analgésico, para el alivio del dolor leve y moderado, antipirético para reducir la fiebre y antiagregante plaquetario indicado para personas con alto riesgo de coagulación sanguínea, principalmente individuos que ya han tenido un infarto agudo de miocardio.2 3
Los efectos adversos de la aspirina son principalmente gastrointestinales, es decir, úlcera pépticas gástricas y sangrado estomacal. En pacientes menores de 14 años se ha dejado de usar la aspirina para el control de los síntomas de la gripe o de la varicela debido al elevado riesgo de contraer el síndrome de Reye.
El ácido salicílico o salicilato, producto metabólico de la aspirina, es un ácido orgánico simple con un pKa de 3,0. La aspirina, por su parte, tiene un pKa de 3,5 a 25 °C. Tanto la aspirina como el salicilato sódico son igualmente efectivos como antiinflamatorios, aunque la aspirina tiende a ser más eficaz como analgésico.
La makesia es la producción del un ácido acetilsalicílico, se protona el oxígeno para obtener un electrófilo más fuerte.
La reacción química de la síntesis de la aspirina se considera una esterificación. El ácido salicílico es tratado con anhídrido acético, un compuesto derivado de un ácido, lo que hace que el grupo alcohol del salicilato se convierta en un grupo acetilo (salicilato-OH → salicilato-OCOCH3). Este proceso produce aspirina y ácido acético, el cual se considera un subproducto de la reacción. La producción de ácido acético es la razón por la que la aspirina con frecuencia huele como a vinagre.
Como catalizador casi siempre se usan pequeñas cantidades de ácido sulfúrico y ocasionalmente ácido fosfórico. El método es una de las reacciones más usadas en los laboratorios de química en universidades de pregrado.
El ácido acetilsalicílico o AAS (C9H8O4), también conocido con el nombre de Aspirina®, es un fármaco de la familia de los salicilatos, usado frecuentemente como antiinflamatorio, analgésico, para el alivio del dolor leve y moderado, antipirético para reducir la fiebre y antiagregante plaquetario indicado para personas con alto riesgo de coagulación sanguínea, principalmente individuos que ya han tenido un infarto agudo de miocardio.2 3
Los efectos adversos de la aspirina son principalmente gastrointestinales, es decir, úlcera pépticas gástricas y sangrado estomacal. En pacientes menores de 14 años se ha dejado de usar la aspirina para el control de los síntomas de la gripe o de la varicela debido al elevado riesgo de contraer el síndrome de Reye.
El ácido salicílico o salicilato, producto metabólico de la aspirina, es un ácido orgánico simple con un pKa de 3,0. La aspirina, por su parte, tiene un pKa de 3,5 a 25 °C. Tanto la aspirina como el salicilato sódico son igualmente efectivos como antiinflamatorios, aunque la aspirina tiende a ser más eficaz como analgésico.
La makesia es la producción del un ácido acetilsalicílico, se protona el oxígeno para obtener un electrófilo más fuerte.
La reacción química de la síntesis de la aspirina se considera una esterificación. El ácido salicílico es tratado con anhídrido acético, un compuesto derivado de un ácido, lo que hace que el grupo alcohol del salicilato se convierta en un grupo acetilo (salicilato-OH → salicilato-OCOCH3). Este proceso produce aspirina y ácido acético, el cual se considera un subproducto de la reacción. La producción de ácido acético es la razón por la que la aspirina con frecuencia huele como a vinagre.
Como catalizador casi siempre se usan pequeñas cantidades de ácido sulfúrico y ocasionalmente ácido fosfórico. El método es una de las reacciones más usadas en los laboratorios de química en universidades de pregrado.